23/08/2024
En el marco de la revisión de 22 Ingredientes Farmacéuticos Activos (IFAs) que fueron establecidos por el Ministerio de Salud de la Nación a través de la Resolución MS N° 284/24 y de las cuales el grupo terapéutico de los “prazoles” ya han sido evaluados, esta Administración Nacional informa que evaluó y realizó la revisión de los siguientes productos:
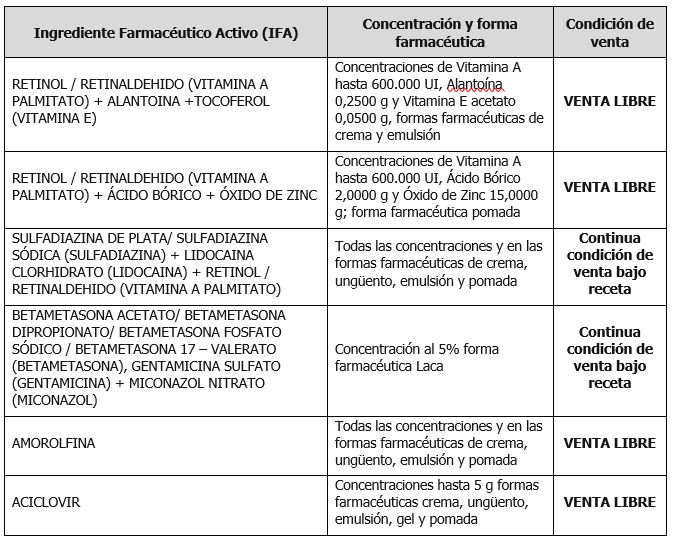
- Retinol/Retinaldehído (Vitamina A Palmitato) + Alantoína +Tocoferol (Vitamina E) (Clasificación ATC DO2AX)
- Retinol/Retinaldehído (Vitamina A Palmitato) + Ácido Bórico + Óxido De Zinc (Clasificación ATC DO2AX)
- Sulfadiazina de Plata/Sulfadiazina Sódica (Sulfadiazina) + Lidocaína Clorhidrato (Lidocaína) + Retinol/Retinaldehído (Vitamina A Palmitato) (Clasificación ATC D06ba51)
- Betametasona Acetato/Betametasona Dipropionato/Betametasona Fosfato Sódico/Betametasona 17 – Valerato (Betametasona), Gentamicina Sulfato (Gentamicina) + Miconazol Nitrato (Miconazol) (Clasificación ATC D07XC)
- Amorolfina (Clasificación ATC D01AE16)
- Aciclovir (Clasificación ATC D06BB03)
De este modo, por medio de la Disposición Nº 7449/2024 se establecieron los cambios en la condición de venta de algunos IFAs antes mencionados.
Los IFAS mencionados se evaluaron teniendo en cuenta los requisitos mínimos para el cambio de condición de expendio a venta libre de una especialidad medicinal, según lo establece la Disposición ANMAT N° 3686/11. De este modo, se revisó que posean demostrada eficacia y seguridad a través del tiempo para ser usadas en el alivio de síntomas o signos fácilmente reconocibles por el usuario y un amplio margen terapéutico de manera tal que la administración de una dosis mayor a la recomendada o la utilización por más tiempo del indicado no represente un daño grave para la salud de la población. También se tuvo en cuenta que la especialidad medicinal haya sido comercializada bajo la condición de venta bajo receta en el país, al menos durante los últimos 5 años sin haber presentado reportes de eventos adversos graves que afectaren el balance riesgo-beneficio.
Las asociaciones siguientes
- Sulfadiazina de Plata/ Sulfadiazina Sódica (Sulfadiazina) + Lidocaína Clorhidrato (Lidocaína) + Retinol / Retinaldehído (Vitamina A Palmitato);
- Betametasona Acetato/ Betametasona Dipropionato/ Betametasona Fosfato Sódico / Betametasona 17 – Valerato (Betametasona), Gentamicina Sulfato (Gentamicina) + Miconazol Nitrato (Miconazol),
No cambian su condición de venta por encontrarse alcanzadas por la ley N° 27.680, reglamentada por el Decreto 386/2023, que establece que la condición de expendio de todas las especialidades medicinales cuyo IFA tenga actividad antimicrobiana sistémica deber ser de venta bajo receta archivada.
La ANMAT instruyó a los titulares de los registros de las especialidades medicinales que cambian su condición de venta para que implementen, en los lotes liberados con posterioridad a la entrada en vigencia de la norma, un sobreetiquetado de seguridad en los envases secundarios que contendrá la nueva condición de venta junto a un código QR. De este modo, coexistirán productos indicando tanto la condición de VENTA LIBRE como su anterior condición de venta bajo receta.
Esta Administración continuará el monitoreo de las especialidades medicinales mencionadas, a los fines de observar en todo momento que los beneficios superen a los riesgos en resguardo de la salud de la población.
Ante cualquier consulta, puede comunicarse con el programa de ANMAT Responde al 0800-333-1234 o por correo electrónico a responde@anmat.gob.ar.
Fuente: ANMAT. 22/08/2024. Disponible en: https://www.argentina.gob.ar/noticias/nuevas-ifas-cambian-su-condicion-venta-libre

